GENERALIDADES DE LA QUIMICA
¿QUE ES LA QUIMICA?
La química es la ciencia que estudia la estructura, composición y propiedades de la materia así como
los cambios energéticos e internos que experimenta.
Las disciplinas de la química se agrupan según la clase de materia bajo
estudio o el tipo de estudio realizado. Entre éstas se tienen la quimica inorgancia, que estudia la materia inorgánica; la quimica organica, que estudia la materia orgánica; la bioquimica, que estudia las substancias existentes en organismos biológicos; la fisicoquimica, que comprende los aspectos energéticos de sistemas químicos a escalas macroscópicas, moleculares y atómicas, o la quimica analitica, que analiza muestras de materia y de entender su composición y estructura.
RELACION DE LA QUIMICA CON OTRAS CIENCIAS
OBJETIVOS DE LA QUIMICA
La Química es la ciencia que tiene como objetivo primordial averiguar cómo los materiales pueden identificarse o distinguirse en cuanto a su composición, propiedades y transformaciones pero lo que distingue a la Química de otras disciplinas que también se ocupan del estudio de la materia es que relaciona todo esto con su microestructura; es decir con el mundo de las partículas que la constituyen.
BENEFICIOS DE LA QUIMICA
Practicamente todo lo que te rodea necesitó a la química para realizarse:
El procesado de alimentos
Purificación de agua
Aleaciones
Acero inoxidable
El plástico
Baterías
Medicina
Papel
Medicamentos
Tintas
Colorantes
Saborizantes, etc.
RIESGOS DE LA QUIMICA
Un Riesgo químico es aquel riesgo susceptible de ser producido por una exposición no controlada a agentes químicos la cualpuede producir efectos agudos o crónicos y la aparición de enfermedades. Los riesgos químicos también pueden provocar consecuencias locales y sistémicas según la naturaleza del producto y la vía de exposición. Algunos riesgos de estos productos pueden ser:
Explosivos
Inflamables
Comburentes
Corrosivos
Irritante
Nocivos
Tóxicos
Radiactivos
Peligroso para el medio ambiente
LA QUIMICA EN EL MEDIO AMBIENTE
En la actualidad el medio ambiente se ve afectado por diferentes procesos contra los que todos debemos luchar: la lluvia ácida, el efecto invernadero, la destrucción de la capa de ozono, la contaminación de aguas y tierras y las emisiones radiactivas.
Los cambios medioambientales son debidos, en
ocasiones, a actividades humanas como incendios, industrias, utilización
de vehículos, etc; y otras vecea a actividades naturales como
erupciones volcánicas, tormentas y otros fenómenos meteorológicos. la
Química analiza los cambios para tratar de determinar la causay, si es
posible, corregirla.
Mucha gente considera que las industrias químicas y la química en sí
son muy perjudiciales para el
medioambiente. No obstante, son numerosos los avances y las
investigaciones científicas en el campo de la química que están
permitiendo desarrollar unos materiales y unas aplicaciones que protegen
el medioambiente y conservan la calidad y el estilo de vida que
deseamos.
METODO CIENTIFICO
El metodo cientifico es un proceso ordenado destinado a explicar fenómenos, establecer relaciones entre los hechos y enunciar leyes para demostración con el fin de exponer y confirmar sus teorías.
 Metodología
Metodología
CLASIFICACION DE LA QUIMICA
MATERIA Y ENERGIA
MATERIA

Materia es todo aquello que ocupa un lugar en
el espacio, posee una cierta cantidad de energía, susceptible de toda clase de formas y de sufrir cambios, que se caracteriza por un conjunto de propiedades físicas o químicas.
ENERGIA
 La energia refiere a la capacidad de poner en movimiento o transformar algo. La energía química, por lo tanto, es aquella producida por reacciones químicas.
Un ejemplo de energía química es la que desprende el carbón al
quemarse. Las pilas y las baterías también poseen energía química.
La energia refiere a la capacidad de poner en movimiento o transformar algo. La energía química, por lo tanto, es aquella producida por reacciones químicas.
Un ejemplo de energía química es la que desprende el carbón al
quemarse. Las pilas y las baterías también poseen energía química.
CUERPO
Es una porcion limitada de la materia, ocupa un lugar en el espacio que no puede ser ocupado al mismo tiempo por otro cuerpo
SUSTANCIA
Una sustancia es la materia de la que está formado un cuerpo.
Las sustancias pueden ser:
MEZCLAS
Una mezcla es un sistema material formado por dos o más componentes unidos, pero no combinados químicamente. En una mezcla no ocurre una reacción química y cada uno de sus componentes mantiene su identidad y propiedades químicas.Las mezclas, por lo tanto, están formadas por varias sustancias que no mantienen interacciones quimicas.
Las mezclas homogenea es la que presenta una composicion uniforme, en la cual no se pueden distinguir a simple vista sus componentes; en muchos casos, no se distinguen ni con instrumentos como el microscopio. Por ejemplo: el agua, la sal, el aire, la leche, el azucar y el plastico.TIPOS DE MEZCLAS
Las mezclas heterogenea es aquella cuyos componentes se distinguen unos de otros, tal es el caso de la madera, el màrmol, una mezcla de agua con aceite, o bien de frutas, entre otros.

 |
PROPIEDADES DE LA MATERIA
Son aquellas que le dan la caracteristica "UNICA" a la materia y pueden ser fisicas y quimicas.
Las Propiedades Físicas
Son aquellaspropiedades
que se pueden medir sin que se afecte la composición o la identidad de
la sustancia. Ejemplo de estas propiedades son la densidad, el punto de
fusión, el punto de ebullición, entre otras.
Las Propiedades Químicas
Son aquelas que nos indican la tendencia de las sustancias para reaccionar y transformarse en otras sustancias, como oxidarse, combustibles, inflamables, estallar o enmohecerse.Sufre alteracion en su estructura interna o molecular cuando actuan en otras sutancias.
PROPIEDADES ORGANOLEPTICAS
son todas aquellas descripciones de las características físicas que tiene la materia en general, según las pueden percibir los sentidos, por ejemplo su textura, olor, sabor,color. Su estudio es importante en las ramas de la ciencia en que es habitual evaluar inicialmente las características de la materia sin la ayuda de instrumentos científicos.
PROPIEDADES INTENSIVAS Y EXTENSIVAS
Propiedades Extensivas: Son aquellas que si dependen de la cantidad de materia en una sustancia. Por ejemplo cuando hablamos del volumen de un cuerpo veremos que este varía dependiendo si tiene mas o menos masa. Dos litros de agua tendrán mas masa que 500 cm3 (medio litro) y por ende mas volumen. Si comparamos dos objetos del mismo grosor pero de distinta longitud como dos lapices sabremos que el mas largo tendrá mas masa. Volumen, longitud, masa, peso, etc constituyen asi propiedades extensivas de la materia.
Propiedades Intensivas: En el caso de las propiedades intensivas, estas no dependen de la cantidad de materia en una sustancia o cuerpo. Por ejemplo cuando medimos el punto de ebullición del agua, que es de 100°C ante una presión externa de 1 atmósfera, obtendremos el mismo valor si se trata de un litro de agua o dos o tres o 200 cm3. Lo mismo con el punto de congelación. El agua a 0°C comienza a solidificarse a una presión externa de una atmósfera, pero sera la misma temperatura para un cubito de hielo que se forme o para una masa mayor. La densidad o peso específico de una sustancia también es un ejemplo claro de esto. Como sabemos la densidad es la relación entre la masa y el volumen que ocupa un cuerpo. Si aumenta la masa aumentara también el volumen, por lo tanto el valor de la densidad se mantendra constante. Por ejemplo, la densidad del aluminio es de 2,7 grs/cm3 (gramos por centímetro cúbico). No importa si se trata de 600 gramos de aluminio o de 4 kilogramos. Otras comunes son color, olor o sabor.
Existen otras no tan comunes en los cursos básicos de química o física como índice de refracción, viscocidad, grado de dureza, etc.
LAS PROPIEDADES GENERALES DE LA MATERIA SON:

Entre las propiedades particulares de los solidos estan:

La fuerza de cohesion
Es la fuerza con la que las particulas son capaces de permanecer lo mas unidas posibles.La fuerza de repulsión
Es aquella que ocasiona que dos cuerpos al intentar acercarlos, los obliga a alejarse.
ESTADOS DE LA MATERIA
La materia se presenta en tres estados o formas de agregación: sólido, líquido y gaseoso.
Dadas las condiciones existentes en la superficie terrestre, sólo algunas sustancias pueden hallarse de modo natural en los tres estados, tal es el caso del agua.
La mayoría de sustancias se presentan en un estado concreto. Así, los metales o las sustancias que constituyen los minerales se encuentran en estado sólido y el oxígeno o el CO2 en estado gaseoso:
- Los sólidos: Tienen forma y volumen constantes. Se caracterizan por la rigidez y regularidad de sus estructuras.
- Los líquidos: No tienen forma fija pero sí volumen. La variabilidad de forma y el presentar unas propiedades muy específicas son características de los líquidos.
- Los gases: No tienen forma ni volumen fijos. En ellos es muy característica la gran variación de volumen que experimentan al cambiar las condiciones de temperatura y presión.
ESTADO FISICOS DEL AGUA
LA ENERGIA CONCEPTO Y CLASES
LA ENERGIA
Es una propiedad asociada a los objetos y sustancias y se manifiesta en las transformaciones que ocurren en la naturaleza, esta se relaciona con:
CAMBIOS FISICOS: LEVANTAR UN OBJETO.
CAMBIOS QUIMICOS: PRENDER UNA FOGATA.
TIPOS DE ENERGIA
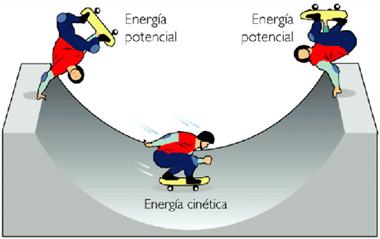
ENERGIA POTENCIAL.-es el tipo de energía asociada a la posición o configuración de un objeto.
ENERGIA CINETICA.-es aquella que se deriva del movimiento de un objeto.
ENERGIA MECANICA.-es la producida por fuerzas de tipo mecánico, como la elasticidad, la gravitación, etc.
ENERGIA ELECTRICA.-es causada por el movimiento de las cargas eléctricas en el interior de los materiales conductores electricos.
ENERGIA LUMINICA.- es la que se transporta por la luz y siempre es producida por las ondas de la luz.
ENERGIA NUCLEAR.-es aquella que se libera como resultado de una reacción nuclear.
ENERGIA SOLAR.-es la energia procedente del sol.
ENERGIA HIDRAULICA.-es la energia producida por la fuerza del agua
ENERGIA ELECTROMAGNETICA.-es la cantidad de energía almacenada debido a la presencia de un campo electromagnético.
ENERGIA EOLICA.- es la energía obtenida del viento,

LEY DE CONSERVACION DE MASA Y LEY DE CONSERVACION DE ENERGIA
Las
leyes se unifican en la ley de conservación de masa y energía: ‟La
cantidad de materia y energía en el universo no aumenta ni disminuye,
pero pueden transformarse entre sí”
EL SISTEMA INTERNACIONAL DE UNIDADES
El Sistema Internacional de Unidades, abreviado SI, también
denominado Sistema Internacional de Medidas, es el nombre que recibe el
sistema de unidades que se usa en la mayoría de los países y es la forma
actual del sistema métrico decimal.
A pesar de haber transcurrido más de 50
años desde el inicio del uso del Sistema Internacional
de Unidades (SI) y su paulatina instrumentacion, este sistema no ha tenido hasta la fecha una difusión
comparable a la del Sistema Métrico Decimal (SMD)
en sus tiempos.
El Sistema Internacional de Unidades también es conocido como
sistema métrico, especialmente en las naciones en las que aún no se ha
implantado para su uso cotidiano. Fue creado en 1960 por la Conferencia
General de Pesos y Medidas, que inicialmente definió seis unidades
físicas básicas. En 1971, fue añadida la séptima unidad básica, el mol.
Una de las principales características, que constituye la gran ventaja
del SI, es que sus unidades están basadas en fenómenos físicos
fundamentales. La única excepción es la unidad de la magnitud masa, el
kilogramo, que está definida como la masa del prototipo internacional
del kilogramo o aquel cilindro de platino e iridio almacenado en una
caja fuerte de la Oficina Internacional de Pesos y Medidas.
Definiciones de las unidades básicas
- Kelvin (K). Unidad de temperatura termodinámica.
- Definición: Un kelvin es la temperatura termodinámica correspondiente a la fracción 1/273,16 de la temperatura termodinámica del punto triple del agua.
- Segundo (s). Unidad de tiempo.
- Definición: El segundo es la duración de 9 192 631 770 periodos de la radiación correspondiente a la transición entre los dos niveles hiperfinos del estado fundamental del átomo de cesio 133.
- Metro (m). Unidad de longitud.
- Definición: Un metro es la longitud de trayecto recorrido en el vacío por la luz durante un tiempo de 1/299 792 458 de segundo.
- Gramo (g). Unidad de masa.
- Definición: Un gramo es una masa igual a la almacenada en un prototipo.
- Amperio (A). Unidad de intensidad de corriente eléctrica.
- Definición: Un amperio es la intensidad de una corriente constante que manteniéndose en dos conductores paralelos, rectilíneos, de longitud infinita, de sección circular despreciable y situados a una distancia de un metro uno de otro en el vacío, produciría una fuerza igual a 2•10-7 newton por metro de longitud.
- Mol (mol). Unidad de cantidad de sustancia.
- Definición: Un mol es la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos hay en 0,012 kilogramos de carbono 12. Cuando se emplea el mol, es necesario especificar las unidades elementales, que pueden ser átomos, moléculas, iones, electrones u otras partículas o grupos especificados de tales partículas.
- Candela (cd). Unidad de intensidad luminosa.
- Definición: Una candela es la intensidad luminosa, en una dirección dada, de una fuente que emite una radiación monocromática de frecuencia 540•1012 hercios y cuya intensidad energética en dicha dirección es 1/683 vatios por estereorradián.
ATOMO Y ESTRUCTURA ATOMICA
TEORIAS ATOMICAS
El átomo es la unidad básica de toda la materia, la estructura que define a
todos los elementos y tiene propiedades químicas bien definidas. Todos
los elementos químicos de la tabla periódica están compuestos por átomos
con exáctamente la misma estructura y a su vez, éstos se componen de
tres tipos de partículas, como los protones, los neutrones y los
electrones.
MODELO ATOMICO DE DALTON
Aproximadamente por el año 1808, Dalton define a los átomos como la unidad constitutiva de los elementos (retomando las ideas de los atomistas griegos). Las ideas básicas de su teoría, publicadas en 1808 y 1810 pueden resumirse en los siguientes puntos:
- La materia está formada por partículas muy pequeñas para ser vistas, llamadas átomos.
- Los átomos de un elemento son idénticos en todas sus propiedades, incluyendo el peso.
- Diferentes elementos están formados por diferentes átomos.
- Los compuestos químicos se forman de la combinación de átomos de dos o más elementos, en un átomo compuesto; o lo que es lo mismo, un compuesto químico es el resultado de la combinación de átomos de dos o más elementos en una proporción numérica simple.
- Los átomos son indivisibles y conservan sus características durante las reacciones químicas.
- En cualquier reacción química, los átomos se combinan en proporciones numéricas simples.
- La separación de átomos y la unión se realiza en las reacciones químicas. En estas reacciones, ningún átomo se crea o destruye y ningún átomo de un elemento se convierte en un átomo de otro elemento.
MODELO ATOMICO DE THOMSON
Thomson sugiere un modelo atómico que tomaba en cuenta la existencia del electrón, descubierto por él en 1897. Su modelo era estático, pues suponía que los electrones estaban en reposo dentro del átomo y que el conjunto era eléctricamente neutro. Con este modelo se podían explicar una gran cantidad de fenómenos atómicos conocidos hasta la fecha. Posteriormente, el descubrimiento de nuevas partículas y los experimentos llevado a cabo por Rutherford demostraron la inexactitud de tales ideas.
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas.
Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva.
En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones
MODELO ATOMICO DE RUTHERFORD
CLASIFICACION
GRUPOS
A las columnas verticales de la tabla periódica se les conoce como grupos. Hay 18 grupos en la tabla periódica estándar, de los cuales diez son grupos cortos y los ocho restantes largos, que muchos de estos grupos correspondan a conocidas familias de elementos químicos: la tabla periódica se ideó para ordenar estas familias de una forma coherente y fácil de ver.PERIODOS
En la tabla periódica los elementos están ordenados de forma que aquellos con propiedades químicas semejantes, se encuentren situados cerca uno de otro.TIPOS DE ENLACE
PUENTES DE HIDRÓGENO